Las proteínas se clasifican en holoproteínas si están constituidas únicamente por aminoácidos y heteroproteínas si además contienen sustancias no proteicas. La parte no proteica se llama grupo prostético.
HOLOPROTEÍNAS
Se dividen en dos grandes grupos atendiendo a su estructura: globulares y fibrosas.
- PROTEÍNAS FIBROSAS, FILAMENTOSAS O ESCLEROPROTEÍNAS: Son insolubles en agua y de forma alargada, ya que generalmente los polipéptidos de estas proteínas están enrollados en una sola dimensión formando fibras paralelas. Destacan:
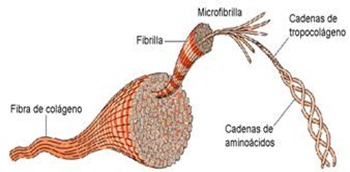
- Colágeno: en esta proteína sus cadenas polipeptídicas se unen formando una triple hélice. Presenta gran resistencia al estiramiento y aparece en la matriz del tejido conjuntivo, cartilaginoso y óseo. Es la proteína más abundante de los vertebrados superiores, pues constituye un tercio de la proteína total del cuerpo.
- 
- Queratina: la α-queratina aparece formando parte del cabello, la lana, la piel, uñas... sus cadenas polipeptídicas se disponen formando una triple hélice. La β-queratina de las fibras de seda es la fibroína.
- Miosina: es una proteína muscular que participa en la contracción muscular.
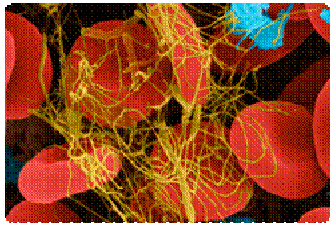
- Fibrina: interviene en la coagulación sanguínea al unirse con las células sanguíneas formando una red o entramado insoluble. Esta proteína se obtiene a partir del fibrinógeno, una proteína sanguínea globular que se puede transformar en fibrina.
Fíjate en la imagen izquierda.Las estructuras finas y alargadas son fibrinas uniendo glóbulos rojos, produciendo coagulación de la sangre.
- PROTEÍNAS GLOBULARES: Suelen ser solubles en agua, tienen una estructura más compleja y con más plegamientos que le dan una forma más o menos esferoidal. Entre ellas destacan:
- Globulinas: son las proteínas globulares de mayor tamaño y con forma globular casi perfecta como la lactoglobulina de la leche, la ovoglobulina del huevo, la seroglobulina de la sangre y las inmunoglobulinas o γ-globulinas o anticuerpos y las α y β-globulinas de la hemoglobina.
- Albúminas: tienen funciones de reserva de aminoácidos o de transporte como la lactoalbúmina de la leche, la ovoalbúmina del huevo y la seroalbúmina de la sangre.
- Histonas: son proteínas que se asocian con el ADN formando la cromatina y los cromosomas, además tienen un importante papel en la regulación genética.
- Actina: junto con la miosina son responsables de la contracción muscular.
HETEROPROTEÍNAS
Se clasifican según su grupo prostético (parte no proteica) en:
- Nucleoproteínas: son complejos entre ácidos nucleicos y proteínas básicas como las histonas (las histonas puedes encontrarlas en holoproteínas o en heteroproteínas según se considere o no el ADN como un grupo prostético).
- Glucoproteínas: su grupo prostético es un glúcido, como por ejemplo muchas proteínas de la membrana citoplasmática que actúan como factores de reconocimiento como son los que determinan los grupos sanguíneos.
- Lipoproteínas: su grupo prostético son lípidos, los más conocidos son las lipoproteínas transportadoras de la sangre como HDL y LDL.
- Fosfoproteínas: su grupo prostético es el ácido fosfórico (grupo fosfato), por ejemplo la caseína de la leche.
- Cromoproteínas: su grupo prostético es una sustancia coloreada, es decir, un pigmento. Se clasifican en dos grupos según posean o no en su estructura la porfirina.
- Cromoproteínas de naturaleza porfirínica o con pigmentos porfirínicos: su grupo prostético es la porfirina, es decir, un anillo tetrapirrólico. En el centro de este anillo hay un catión metálico; el más conocido es el ión ferroso (Fe2+), en este caso, la porfirina se llama grupo hemo y aparece en la hemoglobina que trasporta oxígeno en la sangre y en la mioglobina que transporta oxígeno en el músculo.
Grupo hemo de la hemoglobina
¿Por qué la hemoglobina aparece tanto en holoproteínas como en heteroproteínas?

Estructura tridimensional de un citocromo: fíjate en el anillo tetrapirrólico o porfirina.
- Cromoproteínas de naturaleza no porfirínica: su grupo prostético no es la porfirina, por ejemplo la hemocianina que es un pigmento azulado que lleva cobre y transporta oxígeno en algunos invertebrados; y la rodopsina presente en las células de la retina, esta proteína es imprescindible para realizar el proceso visual ya que es una molécula que capta luz.
Ejercicio: Crea una tabla con las 4 estructuras de las proteínas en una columna, en otra nombra el/los enlaces que estabilizan cada una y en otra haz un dibujo de cada tipo de estructura.



Comentarios
Publicar un comentario
Gracias por dejarnos tus inquietudes y consultas, en breve nos comunicaremos.